皮肤自体移植术是一种常见的临床重建手术,应用广泛,但很少有研究对皮肤移植片的血管和结构特征进行非侵入性评估及监测。华盛顿大学研究人员Anthony J. Deegan等使用自制的临床原型光学相干断层扫描(OCT)系统,在多个时间点多个位置,采集了严重皮肤烧伤后,接受中厚皮片移植手术的患者的OCT/OCTA图像。最终纳入研究的两名患者(患者#1和#2)中,患者#1的定量图像分析结果表明,术后16天的整合层厚度明显小于术后7天(~50%)。而患者#2术后6至14天,移植物和相应整合层的血管面积密度显著增加(~20%)。表明OCT/OCTA能够在中厚皮片移植手术后几天和几周内,成像并测量人体皮肤移植健康及整合情况。shouci证明了非侵入性成像技术在该临床应用中的适用性。文章以“Imaging human skin autograft integration with optical coherencetomography”为题发表于Quant Imaging Med Surg。
背景
皮肤自体移植是一种重建手术,可将健康的供区皮肤转移到同一个人身上需要修复的受区,广泛用于改善烧伤、创伤或癌症患者的生活质量。皮肤自体移植片可由中厚皮片或全厚皮片移植获得,其中中厚度皮肤移植片包括表皮和不同数量的真皮,厚度在125-750μm,更常用于组织覆盖。因此可视化整个皮肤移植片及其下受体组织,需要能够提供细胞水平分辨率和至少1mm深度的成像技术。皮肤移植片最初没有自身血液供应,必须依赖伤口床获得营养,因此其早期阶段的生存能力*决定于它与下面受体组织的血液供应的整合情况。由血肿、浆膜瘤或感染引起的皮肤移植片与伤口床之间的任何液体积聚都可能影响受体组织的血液供应与移植片的连接,从而导致移植不完整甚至失败。因此评估单个层(移植片)以及移植片和受体组织之间的中间层(整合层)的结构和血管灌注,将极大地帮助早期识别并发症、监测皮肤移植片整合情况。
虽然针对皮肤移植的手术和术后评估及优化方面已有很多研究,但很少有技术能客观又准确地评估术后皮肤移植片的情况。临床环境中,常通过视觉检查评估健康供体来评估移植片的健康情况。在移植失败或整合不*的情况下,活检是目前认为weiyi准确确定失败原因的方法。但活检会导致进一步的组织损伤,可能会耗费时间、增加感染风险,而且如果评估位置选择错误可能得到的结果也不准确,此外重复活检还可能引发疤痕并发症。因此亟需一种非侵入性的成像方式来帮助监测移植片的健康状况。
光学相干断层扫描(OCT)具有细胞级分辨率、约1.5mm成像深度和3D成像能力,有可能实现对皮肤移植片的wuchuang成像和实时监测。且随着分辨率、灵敏度和扫描速度的提高,OCT正迅速成为皮肤科研究和临床实践的重要工具。基于OCT的血管造影(OCTA)可提供组织结构以外的信息,如识别功能血管,通过快速连续测量同一位置多个时间点的OCT信号差异来区分血管和周围静态组织。此外算法开发的进步,如衰减校正、分割、面内绘图、厚度测量和血管测量,允许对单个层中的结构和血管特征进行定性和定量的成像及分析。
本研究旨在探索应用OCT/OCTA成像技术,观察并监测自体皮肤移植片愈合和整合的潜力。使用了能够提取OCTA信息的原型OCT成像系统来可视化并分析移植片本身,及其下相应的整合层的血管(OCTA导出血管映射)和结构(OCT导出衰减校正映射)特征。
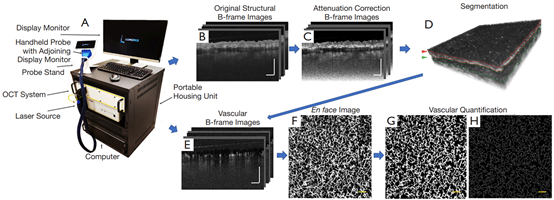
图1 OCT系统的原型以及数据处理示意图。(A)采集OCTA数据的OCT原型系统;(B)原始结构横截面B-frame图像;(C)衰减校正截面B-frame图像;(D)3D结构图像。红线为移植层边界(红色箭头为移植层),绿线为整合层边界(绿色箭头为整合层)。使用这些线进行层分割;(E)血管横截面B-frame图像;(F)3D血管的原始en face投影;(G)用于量化血管面积密度的二值化血管图像;用于血管直径量化的骨架化血管图像。
结果
图2为患者#1右前臂背侧移植片内及其正下方的血管变化(通过en face血管图获得)。图2A和F分别为术后第7天和第16天的移植前臂,标示了大致的扫描位置和移植片分界线。对移植片、邻近烧伤和同等健康部位(对侧前臂)进行了多次OCT以进行比较。图2D和放大插图2E可见对照部位的血管形态、密度和分布都很均匀。相比之下,与移植片相邻的烧伤部位(图2I和J)显示,烧伤受损皮肤的血管密度*,即使在烧伤后23天,也很难识别单个血管形态。移植片的表面血管虽然较少(图2绿色血管),但脉管系统(图2B和C)仅在术后7天其形态和分布已经更接近正常对照组(图2D,E)。图2G和放大插图2H显示了术后16天移植片的脉管系统,与diyi次成像相比,脉管系统看起来更像正常对照。
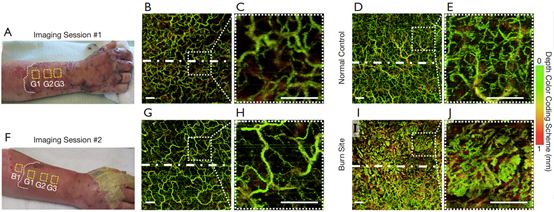
图2 患者#1的en face OCTA成像。(A, F)术后7天和16天移植前臂的照片。G1、G2、G3和B1是大致扫描位置(黄色虚线框)。G1-G3是三个移植部位,B1是与移植片相邻的烧伤部位。白色虚线为移植边界。(B, C)扫描部位G2处术后7天的移植片脉管系统。(D, E)同一患者正常皮肤(对侧前臂)的脉管系统。(G, H)扫描部位G2处术后16天的移植脉管系统。(I, J)扫描部位B1处最初烧伤23天后邻近移植片的烧伤部位的脉管系统。(C, E, H, J)分别为(B, D, G, I)虚线矩形处的放大图。
图3为图2中白色虚线位置组织结构的代表性横截面B-frame(衰减校正处理后),其中表皮-真皮连接和相邻层的边界清晰可见。黄色虚线为表皮和真皮的连接。红色虚线为移植层的下边界和整合层的上边界。绿色虚线为整合层的下边界和受体组织的上边界。图3B为正常对照,结构平滑且均一。图3D为烧伤后表皮粗糙的皮肤结构。图3A移植组织的表皮明显厚于正常对照部位的表皮,整合层也清晰可见。图3C显示随着时间的推移,表皮厚度恢复到接近正常对照组的水平,比较第二次成像和diyi次成像也证明了这一点。此外,与diyi次成像相比,第二次成像中整合层更薄且不明显。
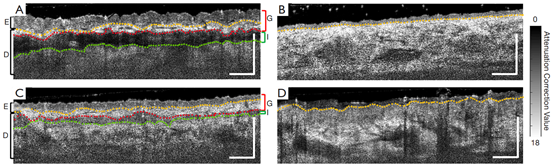
图3 OCT结构的代表性横截面B-frame(衰减校正处理后),由图2中白色虚线处获得。(A)术后7天的移植片;(B)同一患者的正常皮肤(对侧前臂);(C)术后16天的移植片;(D)最初烧伤后23天邻近移植片的烧伤部位。黄色虚线为表皮和皮肤的结合。红色虚线为移植层和整合层之间的边界。绿色虚线为整合层和受体组织之间的边界。
图4为同一移植片分割成两个不同的层,即移植层和整合层,以分别显示每层的脉管系统和厚度图。对于患者#1,与diyi次成像相比,第二次成像时移植片和整合层中的血管分布似乎更均匀。此外,在diyi次和第二次成像期间,移植片和整合层似乎都变薄了。
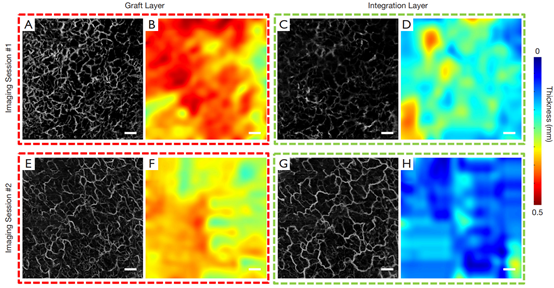
图4 患者#1的en face血管和层厚图,跨越两个成像阶段。(A, C, E, G)分别从移植层和整合层得到的en face投影脉管系统图。(B, D, F, H)分别从移植层和整合层导出的厚度图。
图5为患者#2右前臂腹侧移植片内及其正下方的血管(通过en face血管图)和结构(通过衰减校正图的横截面B-frame)变化。图5A和E分别为术后第6天和第14天的移植前臂。图5B和放大的插图5C为术后6天移植的皮肤,血管密度稀疏。在横截面的B-frame中,移植组织和受体组织之间的间隙清晰可见(图5D)。图5F和G显示,与术后6天的血流相比,术后14天的血流分布更加均匀。图5H可显著发现与diyi次成像相比,第二次成像的整合层不太明显。图5F黄色箭头指示的是深色血管样结构。
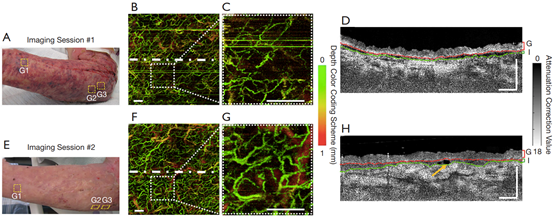
图5 患者#2的en face OCTA图像和结构(衰减校正处理后)横截面B-frame。(A, E)分别为术后6天和14天移植前臂的照片。G1、G2和G3为移植和扫描位置(红色虚线框)。(B, C, D)术后6天G2处的移植片。(F, G, H)术后14天G2处的移植片。(B, C, F, G)彩色编码血管深度的en face投影血管图。(C, G)在B和F中虚线矩形区域的放大图像。(D, H)对应B和F中白色虚线处的OCT结构的横截面B-frame。E,表皮;D,真皮;G,移植片层;I,整合层。
图6为同一移植片扫描,分为两层,即移植片层和整合层,分别显示每层的脉管系统和厚度图。对于患者#2,与diyi次成像相比,第二次成像时移植片和整合层的血管更密集。但在diyi次和第二次成像期间,移植片和整合层的厚度都没有明显变化。
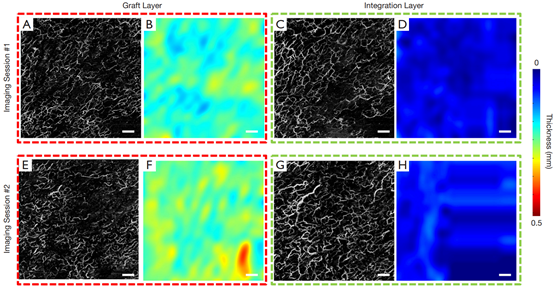
图6 患者# 2跨越两个成像时段的en face投影血管和层厚图。(A, C, E, G)分别从移植层和整合层得到的en face投影血管图。(B, D, F, H)厚度图分别来自移植层和整合层。
Table 1显示了两个患者在两个时间点的层厚测量、血管面积密度和直径测量的详细量化结果。患者#1第二个时间点的整合层厚度明显低于diyi个时间点(P=0.0047)。在患者#2的两次成像期间,移植片血管密度(P=0.042)和整合层血管密度(P=0.0052)均有显著增长。在diyi次和第二次成像期间,患者#2的整合层内的血管直径也显著增加(P=0.042)。

讨论
移植片血运重建对于移植片存活至关重要。OCTA可通过识别血液中运动粒子(即红细胞)和周围静态组织之间的差异来检测功能性血管。也就是说,如果血管中没有血流或者血流太慢而低于其检测极限(通常小于约10μm/s),OCTA不会检测到血流。已知皮肤移植片最初没有自己的血液供应,因此理论上不应该在术后立即观察到任何血流。diyi次成像时,两个患者的移植片和整合层中观察到血流,表明患者#1和患者#2分别在术后7天和6天实现了血运重建,与已有的术后3-7天进行血管重建的理论一致,也证明了OCT/OCTA对皮肤移植片血运重建的评估能力。由于皮肤移植片血运重建背后的确切机制尚未*了解,在探索早期血管转化机制和动力学方面,OCT/OCTA可能发挥重要作用。此外患者#2两个成像时间点间,移植片血管密度(P=0.042)和整合层血管密度(P=0.0052)均观察到显著增长,表明随着时间的推移,皮肤移植片进一步血运重建。
从视觉上看,表皮增厚是移植片水肿的常见特征,在患者#1中很明显,如移植片横截面B-frame图像所示(图3A),随后部分消退(图3C)。水肿被认为是由淋巴功能障碍和炎症引起,后来的淋巴管生有助于水肿的减轻。患者#2的第二次成像过程中,可以看到黑色血管样结构(图5H),患者#1移植层和整合层中也显示了暗血管结构,但不如患者#2明显。这些结构被认为是淋巴管,因为淋巴液几乎透明,使得OCT图像中淋巴管以血管样形状出现在黑暗区域(低散射强度)。因此OCT的结构图像及水肿减轻似乎可以为淋巴管生成提供证据。
从两名患者中得到的血管和结构信息可能允许临床医生或研究人员监测愈合的各个阶段,但比较二者的数据时,还是有其他发现。综合考虑两个时间点,患者#1表皮较厚,使作者认为术后7天水肿仍然存在,术后16天水肿部分消退。然而患者#2的表皮厚度在术后6天明显更稳定,术后14天测量结果无显著差异。与diyi次成像相比,患者#1第二次成像整合层的厚度显著减少(~ 50%)(P = 0.0047),而患者#2由于在diyi次成像期间整合层已经变薄,第二次没有减少。这可能是由于患者#1手术后最初几天出现了一些并发症,因此患者#1维持在发炎状态的时间比患者#2长,这种长期炎症似乎也影响了血管密度和整合层厚度。简而言之,患者#1的并发症和随之而来的炎症导致diyi次成像期间血管密度增加。随着该患者的康复,第二次成像期间的血管重建引起了同样高的血管密度增加。相比之下患者#2没有相同程度的炎症,因此血管密度相对较低,随着愈合,血运重建导致第二次成像时血管密度显著增加。虽然最初看起来好像两个患者的血运重建率不同,但仅仅是由于炎症影响了diyi次成像的数值结果。在第二次成像时,两个病人都正常化。这也突出了非侵入性成像技术相对于其他侵入性方式的优势:可在不干扰愈合过程的情况下更容易地随时间重复测量,实现对愈合进行更深入的评估。
总的来说,本研究虽然存在一定局限性,如视野大小受限、参与者数量不足、OCT自身穿透深度限制。但也确实通过OCT和OCTA实现了对血管和结构特征的观察,这可能对临床医生在术后几天和几周内确定移植皮肤的整合和成熟过程起一定帮助作用。此外从临床角度来看,OCT和OCTA在移植片成像中的应用潜力巨大,OCTA不仅可以用于监测移植片整合,还可在切除前评估供区血管,帮助预测移植片的存活率、评估烧伤部位伤口愈合情况。从临床前的角度看,OCT和OCTA可以用于评估移植操作和工程皮肤组织替代品,如偏振敏感OCT(PS-OCT)足够灵敏,可以检测不同的真皮层以及各向异性的生物结构(如胶原蛋白),这将进一步提高OCT在皮肤自体移植研究中的应用。
结论
皮肤自体移植作为一种治疗策略广泛应用于临床,被纳入包括烧伤、软组织创伤和癌症在内的多种疾病的治疗策略中,但仍有10-30%的失败率。本文shouci展示了OCT和OCTA在中厚皮片手术后几天和几周内,成像并监测人皮肤自体移植手术后的健康及整合情况的能力。shouci证明了wuchuangOCT/ OCTA成像技术在该临床应用中的适用性,对未来的waikeshoushu和临床结果有极大改善作用。
参考文献:Imaging human skin autograft integration with optical coherencetomography. Quant Imaging Med Surg 2021;11(2):784-796. DOI: 10.21037/qims-20-750







