视觉研究中,视网膜疾病的小动物模型非常重要,wuchuang高分辨率的体内鼠视网膜成像是该领域应用的重要工具。加拿大研究人员Yifan Jian等介绍了一种用于小鼠体内视网膜高分辨率成像的定制傅里叶域光学相干断层成像(FD-OCT)设备。为了克服小鼠眼畸变,在折射FD-OCT系统的采样臂中引入一个商用自适应光学系统。使用折射抵消透镜减少了角膜的低阶像差和镜面反射。文章还描述了一种用于修正小鼠眼残余波前像差的自适应光学(adaptive optics, AO)系统的性能,展示了有无AO校正的活体内AO FD-OCT图像。体内成像结果表明视网膜图像中毛细血管和神经纤维束的亮度和对比度得到了改善。文章以“Adaptive optics optical coherence tomography for in vivo mouse retinalimaging”为题发表于J BIOMED OPT。
背景
人类疾病的小动物模型是现代视觉研究的重要组成部分。啮齿动物(如小鼠和大鼠)通常用于开发对抗致盲疾病的新疗法。为了更好地观察细胞的微观结构、了解活体视网膜的分子过程,需要对啮齿动物眼睛进行高分辨率视网膜成像。免疫组织学等技术可作为视网膜研究的金标准,但只能研究单个时间点,还可能需要使用许多动物。而wuchuang成像使研究单个动物在治疗过程中的动态过程和反应成为可能。
对于活体内眼成像,获得细胞级分辨率通常需要大瞳孔及自适应光学(AO)实现。AO能够校正眼睛折射表面引起的像差,实现衍射极限的横向分辨率。使用AO结合眼底摄影、OCT和共焦扫描激光yandijing,已经实现了人感光器马赛克的可视化。已知视力良好的年轻健康志愿者在适当瞳孔大小(3-4mm以下),不使用OA的情况下,可观察到从zhongyang凹偏心2°的锥状马赛克。然而接近zhongyang凹处的锥状或棒状感光器密度要高得多,因此要想提高分辨率并使这些结构可视化,就需要大瞳孔尺寸和AO校正。
小鼠眼睛大小约为人类的1/8,但其数值孔径(NA)是人类的2倍以上。而光学像差对图像质量的影响随着NA的增加而增加,这阻碍了小鼠体内高分辨率成像。为此科学家们做了很多补偿相差尝试:Biss等人的AO生物显微镜和Alt等人用于小鼠视网膜活体成像的AO SLO表明,AO校正单色像差提高了图像的亮度和分辨率;Geng等人证明当一个引发长聚焦深度的小直径波前信标入射到小鼠视网膜上时,Hartmann-Shack波前传感器(WFS)中出现了一个双斑点,而他们zuixin的AO共焦扫描激光xianweijing(cSLO)在活体小鼠视网膜中shouci观察到了光感受器马赛克。
与en face成像方式的cSLO相比,OCT的优势在于能够获得视网膜结构的横截面图像,这一特性使得啮齿动物纵向研究成为可能。除结构信息外,OCT功能扩展(如多普勒OCT和血流对比OCT)还能可视化血管网络。
OCT图像的质量在很大程度上受焦点大小、扫描长度、采样密度影响,OCT B-scan平均技术也会影响散斑(相干噪声)的尺寸和对比度。临床OCT平均图像质量的提高通常是通过斑点图案的模糊来实现,因此横向分辨率降低了2/3或更多。
本研究旨在探讨提高OCT对小鼠视网膜成像的横向分辨率的方法。研究人员将外目标透镜与折射抵消眼底透镜结合以减少小鼠眼像差,利用该技术,在小鼠视网膜体内成像过程中,可以通过增加NA来减小斑点的大小。为了确保光斑尺寸(横向分辨率)的改善不会被因像差增加而产生的斑点模糊而抵消,将自适应光学系统集成到小鼠视网膜OCT成像仪中。使其能够监测并校正折射误差,从而改善聚焦光斑尺寸。体内成像实验结果表明,可以观察到横向分辨率增加及散斑尺寸减小。
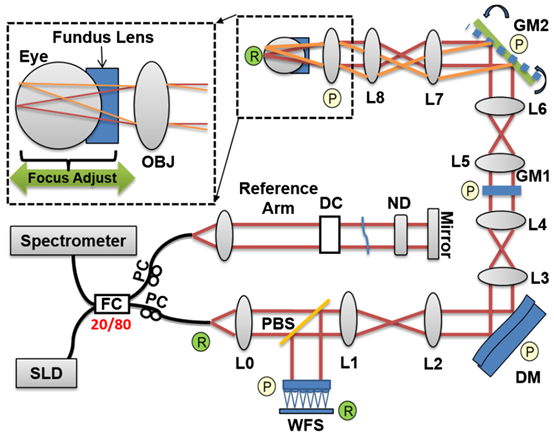
图1 小动物AO FD-OCT系统示意图。
结果
将麻醉小鼠的眼睛对准眼底透镜,通过轴向平移眼底透镜和小鼠进行适度调焦(图1)。由于FD-OCT和波前传感器(WFS)使用同一光源,通过观察B-scan调整焦平面在小鼠视网膜上的位置,可以监测对WFS斑点的影响。图2为来自WFS相机的代表性图像,其中DM保持在推荐的“平坦”位置。图2(a)数据在焦点未优化时获得,B-scan中整个视网膜厚度普遍明亮,波前斑点较大。仔细观察发现波前斑点中有两个峰值,与已报道结果相似。图2(b)中的WFS数据是调整外视网膜上的焦点位置后获得。放大视图中,WFS点似乎变得更圆,并且只包含一个单峰,这对于质心检测和AO像差校正算法非常重要。在相应的同时获得的B-scan中,与图2(a)相比,视网膜外层的强度高于视网膜内层。

图2 WFS相机图像及相同位置同时获取的相应对数标度B-scan。热图中一个WFS点(红色虚线圆圈中)以较高的放大率显示,在黑线位置提取相应的强度分布。(a)具有非优化焦点的WFS图像。(b)优化光束聚焦于视网膜外层获得的WFS图像。
图3(b-d)为成像期间,WFS在AO校正前后记录的均方根误差和Zernike系数测量值。在AO校正前,将小鼠眼睛沿光轴对齐,焦点设置在外视网膜。AO校正前的均方根误差在0.2-0.6 μm范围内,以散焦和散光为主。激活AO校正后,均方根波前误差降低到50 nm左右。绘制了8只小鼠(仅右眼)校正前后每个Zernike系数的平均幅度(平均值标准偏差),展示系统性能(图3e)。

图3(a)用纸模在视网膜平面上测量系统残余像差。(b)小鼠成像过程中RMS波前误差的代表性轨迹。用AO FD-OCT成像小鼠视网膜时,(c)AO校正前和(d)校正过程中测得的相应Zernike系数。(e)对8只小鼠样本测量校正前后Zernike系数和标准差的平均值。
图4为小鼠视网膜定制标准分辨率FD-OCT系统的代表性图像,以及来自具有类似光源(轴向分辨率)的AO FD-OCT系统图像。有文献也描述了用于获取这些图像的标准横向分辨率啮齿动物FD-OCT系统的光学系统。简而言之,系统的高斯束腰(1∕e2)约6.5μm、焦深约308μm(足以容纳小鼠视网膜的全部厚度)。标准分辨率FD-OCT图像的采集和处理与AO FD-OCT系统图像保持一致。图5中的标准分辨率B-scan由1.5 mm横向扫描长度获得。所有主要的视网膜层都可以在图像中识别,且似乎都是明亮的。黄色虚线框中的插图由AO FD-OCT系统获得,所用小鼠与标准分辨率FD-OCT系统成像所用小鼠相同品系。插图中,与标准分辨率FD-OCT图像相比,AO FDOCT光束聚焦在比视网膜内层更亮的视网膜外层。如预期,AO FD-OCT图像中观察到的斑点尺寸明显小于标准分辨率FD-OCT图像中的,从而增强了视网膜层的可见性。
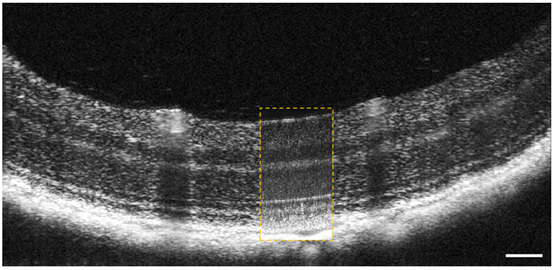
图4 普通啮齿动物OCT B-scan与高分辨率AO-OCT B-scan(AO-ON采集黄色虚线框内)的比较。图像均来自C57BL/6J(色素沉着)小鼠,由20次运动校正B-scan平均产生。数据均采用对数强度标度。AO FD-OCT插图上看到的斑点尺寸较小。比例尺100μm。
为了可视化AO系统对B-scan的影响,在AO系统关闭和打开的情况下,对同一视网膜位置采集了几组数据,并用线性强度标度显示结果。图5(a)为AO系统关闭(OFF)时的图像(flat DM),物镜焦点在外视网膜上。图5(b)为AO开启(ON)时聚焦于外视网膜的B-scan,图5(c)为聚焦于内视网膜的B-scan。AO校正激活(AO-ON)时,B-scan更亮(图5右)。例如当AO被激活并聚焦在外视网膜时,OLM的测量强度增加了约3倍(图5a和b)。焦点偏移的效果可以通过图5(b和c)中相应视网膜层的强度变化来观察。

图5 相同偏心率下获得的C57BL/6J(色素沉着)小鼠视网膜体内OCT B-scan图像(左),及深度-强度曲线(右)。(a)AO关闭时(DM flat)获取,(b)AO激活并将焦点设置在外视网膜时获取,(c)AO激活并通过AO软件将焦点转移到内视网膜时获取。图像(a)、(b)和(c)通过平均20次B-scan生成,并以线性强度标度呈现。比例尺50μm。
激活AO系统后,可以通过改变AO控制软件中的离焦量来调整焦平面位置。在小鼠视网膜的B-scan图像中,可以实时观察到焦平面位置的变化,因为焦平面上各层的亮度显著增加。从光栅扫描获得的AO FD-OCT体积式图中提取小鼠视网膜的en face图像,垂直叠加的B-scan帧间距为0.6μm。图6为视网膜神经纤维层(RNFL)、内网状层(IPL)和外网状层(OPL)的代表性图像。横截面图像中括号所示为聚焦层及创建en face图像所需的像素范围。在同一位置采集四组体积式数据,用相同参数进行后处理,并在相同的线性强度标度上呈现。黄色虚线框中的图像数据沿短轴平均,以生成右侧的强度图(蓝色线表示AO-ON,红色虚线表示AO-OFF)。AO激活后RNFL中神经纤维以及IPL和OPL中毛细血管的锐度和亮度得到改善(图7)。在AO-OFF情况下,只有OPL(图6f)具有足够的对比度以使得能够与对应的AO-ON图像(图6c)进行比较,右栏的线形图形中可观察到毛细血管强度有2-3倍的增加。
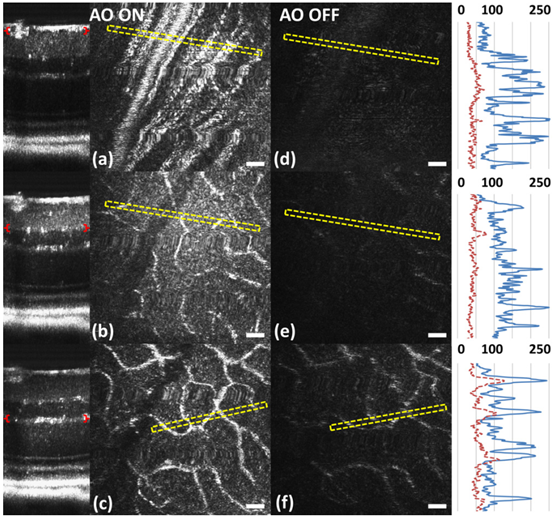
图6 用AO FD-OCT系统体内获得的小鼠视网膜横截面图像。通过改变AO控制软件中的离焦量,将焦平面设置在视网膜内部。B-scan中括号所示的轴向深度代表不同视网膜层的en face投影,分为AO-ON时(a-c)和AO-OFF(DM平面)时(d-f)。比例尺30μm。
图7显示了与图6所示不同的动物视网膜图像。可视化了不同的毛细血管丛层和感光层(PRL),可见强度和分辨率提高(视网膜毛细血管宽度提高)。图7(c和g)中的绿色虚线框表示在AO打开和关闭的情况下测量几个不同尺寸毛细血管宽度的位置。相应的折线图已标准化(图7底部1、2和3)。平均而言,用AO-ON测量的毛细血管直径比AO关闭时约窄2.5×。
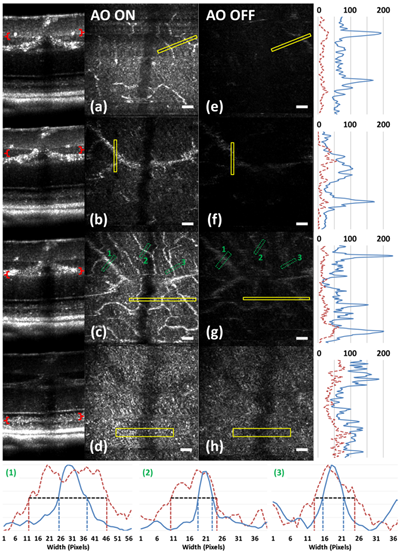
图7 用AO FD-OCT系统体内获得的小鼠视网膜截面和en face图像(IPL、INL、OPL和PRL)。通过改变AO控制软件中的离焦,在感兴趣层上调整焦平面,如B-scan图像中的红色括号。B-scan中括号所示的轴向深度分别表示AO-ON(a-d)和AO-OFF(DM平面)(e-h)时同一位置不同视网膜层的en face投影的位置。底部为c和g中标记1、2和3的位置处毛细血管图像强度的标准化线图。比例尺30μm。
结论与讨论
本文介绍了一种用于小动物视网膜成像的AO FD-OCT系统,系统使用同一光源做成像光源和波前传感光源。为了便于小鼠成像,使用眼底透镜帮助对齐闭并消除角膜屈光。体内实验结果表明,小鼠视网膜图像中毛细血管和神经纤维束的亮度和对比度得到了改善。
自适应光学视网膜成像的关键是精确的波前感知。对于小动物如鼠,尤其具有挑战性。本文AO FD-OCT系统的设计特点之一是使用了眼底透镜消除空气-角膜界面的折射,而不是用物镜聚焦光。该方式通过组合移动眼底透镜和眼睛,使光可以很容易地聚焦在外视网膜上,从而获得单峰高质量的波前图像。此外,通过使用单一光束进行波前传感和FD-OCT,能够通过观察B-scan实时监测成像光束聚焦的视网膜区域。由于被成像的眼睛与眼底晶状体接触,有效减少了角膜干燥和混浊。使用物镜将光聚焦在视网膜上可能会使产生图像平面的曲率场与小鼠视网膜的曲率不匹配,但本文不存在这个问题,因为AO FD-OCT扫描的区域很小,如图5-7中的B-scan图像所示,视网膜表面在短距离内是平坦的。
当前的系统设计中,没有使用小鼠眼球的全部NA。预计分辨率需要提高两倍才能用高对比度来分辨横截面图像和en face图像中完整的光感受器马赛克。与cSLO不同,OCT的轴向分辨率取决于光源的带宽;为了获得超高的轴向分辨率,需要很宽的光谱带宽。这给AO-OCT带来了额外的挑战,因为随着光谱变宽,色差将开始影响光斑大小。需要进一步详细研究这些色差的影响,以利用小鼠眼睛的完整NA。此外,焦点的深度与光斑的大小相耦合;光斑尺寸较小会使焦点深度非常小,小于PRLs厚度。所幸OCT灵敏度非常高,离焦结构仍然可见,但强度和分辨率降低。
未来研究需要提高系统的分辨率和聚焦深度。首先使修改屈光性AO系统,以便通过更大的瞳孔大小对小鼠进行成像,从而提高可实现的理论横向分辨率。此外在啮齿动物AO-OCT系统中加入SLO成像通道(类似Zawadzki等人提出的人视网膜成像设计),将允许使用光遗传学中的新型荧光分子探针,从小鼠体内同时获得结构和潜在功能数据。另外在不牺牲AO提供的横向分辨率的情况下,探究延长AO-FDOCT系统聚焦深度的方法。已知几种可能的高NA OCT成像解决方案,包括使用动态聚焦、实现贝塞尔光束成像或在AO-OCT系统中引入附加像差等。最终的目标是利用自适应光学技术提高横向分辨率,实现体内光感受器的细胞级分辨率成像。
参考文献:Jian, Y. , R. J. Zawadzki , and M. V. Sarunic . "Adaptive optics optical coherence tomography for in vivo mouse retinal imaging." Journal of Biomedical Optics 18(2013).







