Science综述 | 深入揭秘空间组学革命,未来科学新篇章将展开!
时间:2023-09-27 阅读:292
在生物体中,细胞必须在三维组织中相互作用和组装。每个细胞的位置与其内在性质一样重要,可以用来确定组织在疾病中的功能或障碍。最近,在多重空间分子测量方面爆发的创新正在开启生物学研究的新篇章,并使人们重新拥抱生命系统的复杂性。
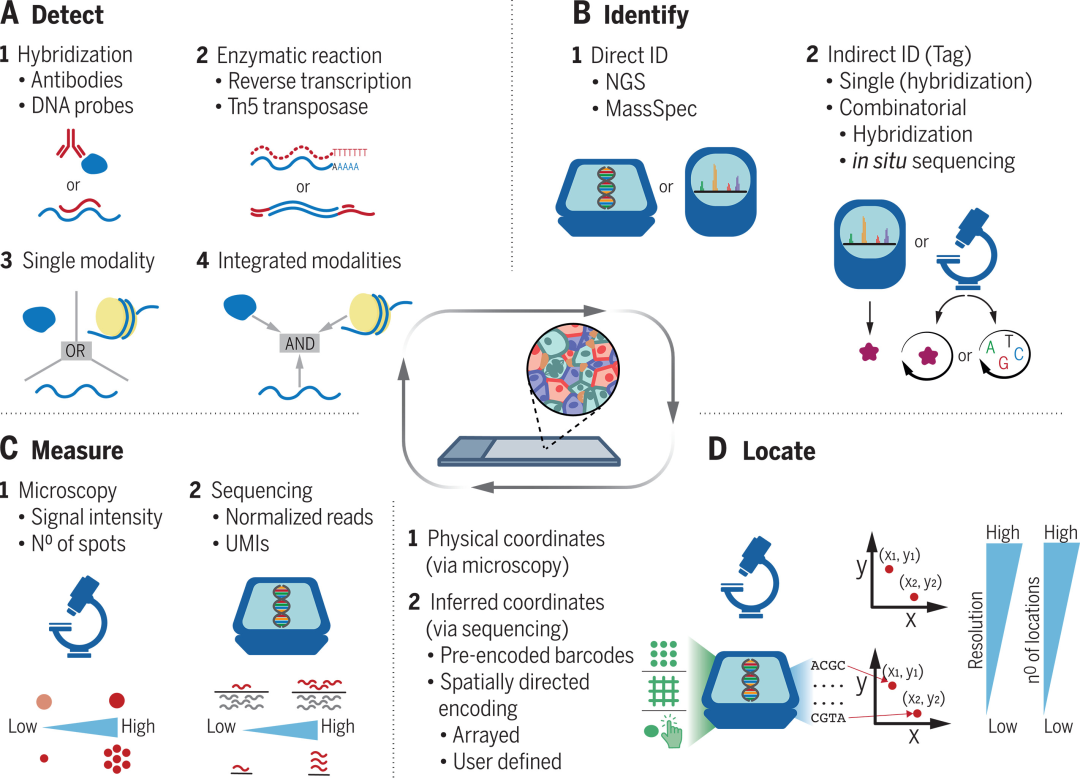
空间组学有望通过同时测量物理组织结构和分子特征,来改变生物学的许多领域并最终che底改变病理学。目前,大量新技术可以对基因和蛋白质表达、基因突变、表观遗传标记、染色质结构和基因组组织进行空间分析。但空间组学技术的分辨率、灵敏度和通量水平截然不同,在易于采用、与不同样品类型的兼容性、商业可用性、前期投资和每个样品的成本方面也存在很大差异。在这个不断发展的领域,选择zuihao的技术来解决特定的生物挑战至关重要。8月4日,剑桥大学科学家在《Science》撰写题为“The dawn of spatial omics”的综述文章,全面梳理了空间组学技术的丰富种类,阐明它们各自的原理、优势和局限性,并就空间组学目前面临的挑战提供了见解。免疫组织化学(IHC)和原位杂交(ISH)方法已使用50多年。空间组学技术可以使用质谱(MS)等非显微方法来检测分析物,执行染色和染料去除循环以达到所需的复杂性,或者利用高通量DNA测序和条形码的力量。更新的质谱流式细胞技术(MC),基于与同位素纯镧系金属缀合的抗体检测,具有非常高的信噪比(SNR),是成像质谱流式细胞技术(IMC)和多重离子束成像(MIBI)的基础。然而受到足够纯金属的可用性的限制,可实现的复杂性在大约50个物种。多重抗体成像的另一种方法是基于在重复成像周期中检测常规标记的荧光抗体。在部分方法中,所有抗体立即与样品结合,并通过二级探针循环进行检测。总的来说,它们相对于MS具有更大的数据生成能力。对于涉及大量样本收集的项目来说,循环成像方法可能是最可行的替代方案。这系列技术的最终目标是,以亚细胞分辨率测量整个组织样本中每个基因和基因亚型的丰度。目前,还没有任何技术能够达到这一目标。空间基因组分析基于四种主要策略。显微切割可能是通过物理分离从特定区域纯化生物分子,来为分子图谱添加空间信息的蕞明显方法。激光捕获显微切割(LCM)通常用于分离小区域(数十至数百个细胞)以进行RNA-seq,并且可以达到单细胞分辨率。最近的研究使用光来空间选择要剖析的区域。光可用于触发逆转录(RT),切割报告基因,贴上纯化标记,或去除测序接头连接的阻碍物(adaptor)。光还可以触发DNA条形码或条形码组合的附着,通过驱动其交联或杂交到组织。然后使用条形码将读取重新分配给这些区域。显微切割技术能提供非常深入的分析,几乎达到批量测序水平,并允许将感兴趣的区域从单个细胞定制到整个区域。但是它们的通量相对较低。循环杂交的方法是单分子FISH(smFISH)的后代,这是一组将组织中的单个mRNA分子解析为亚衍射荧光点的技术。为了实现检测,需要将多个探针与相同的mRNA分子结合。smFISH通常被认为是RNA定量方法中的“金标准”,因为它可以检测非常低丰度的转录本,从它衍生的空间分析技术往往具有出色的灵敏度。MERFISH和seqFISH+是目前可用的两种主要的基于杂交的原位转录组学方法,都已扩展到全转录组水平,成功用于研究不同器官和组织中的空间基因表达,适合通过寡聚抗体同时检测mRNA和蛋白质。两者在灵敏度、通量和优缺点方面实际上非常相似,但在操作和条形码方案细节方面存在一些技术差异。还有其他一些技术如osmFISH、Saber-FISH、Clamp-FISH、SCRINSHOT、EEL-FISH等,其中许多方案可同时分析数千个基因和数十种蛋白质。技术复杂且实施起来费力,限制了该类技术的广泛应用。该方法系列的前提是,对组织切片内原位执行高通量测序,蕞常用的测序技术是连接测序而不是合成测序。共同步骤是通过对检测到的转录本产生的圆形模板进行滚环扩增(RCA),来生产DNA“纳米球”(rolony)。每个mRNA分子都会产生一个单独的rolony,从而可以对转录本进行定量,蕞大读取长度约为30个核苷酸。这些方法包括基于与mRNA杂交的挂锁DNA探针的ISS,和通过cDNA分子的环化产生RCA扩增子的FISSEQ,它们也迅速催生了多种具有更高效率和改进特征的衍生方法,如BaristaSeq。最近,均已与扩展显微镜化学相结合,效率和SNR均得到了显著提高,如ExSeq。基于FISH和基于原位测序的方法有一个共同点:最终通过组织的高分辨率显微镜成像进行检测,并通过有效计数单个mRNA分子来测量基因表达。单分子显微镜非常具有挑战性,需要极其精确的仪器和进程,检测灵敏度也会因细胞大小而产生偏差。在ST中,通过使用微阵列打印技术,将有序的寡核苷酸阵列沉积在载玻片上,然后将薄的组织切片放置在阵列上,进行透化以使细胞RNA扩散到带有条形码的寡核苷酸,并原位反转录以产生空间索引的cDNA,然后产生文库并进行测序。关键优势是能够产生长测序读数、不依赖复杂的成像仪器、高速、用于并行化,极大地促进了其商业应用。然而,也存在一些缺点,包括分辨率低(目前为50至100 μm)、每个样品的成本高以及RNA捕获效率低。Slide-seq和HDST技术将带有条形码的Poly(T)引物附着到纳米珠上,然后将珠子包装在粘性载玻片(Slide-seq)或微孔图案载玻片(HDST)上,达到更高的空间密度(Slide-seq为10 μm,HDST为2 μm)。Slide-seq、HDST和Slide-tags能够以与单细胞大小相当的分辨率进行分析,但这是以更复杂的操作和试剂设置以及更低的RNA捕获效率为代价的。改进方法如Seq-Scope、Stereo-seq和PIXEL-seq都具有相对较高的捕获效率,与scRNA-seq持平或略高。此外,还有DBIT-seq。 空间条形码技术与批量测序相结合非常成功。商业选项的可用性、高精度仪器的不依赖以及与现有工作流程的兼容性降低了进入门槛,数据分析也相当简单。然而,空间条形码相对于样本的低分辨率和随机定位意味着信息有时会混淆结果。方法的选择取决于每个特定研究的具体需求,分辨率、通量、易于实施、稳健性和成本是关键变量。对于蛋白质分析,主要决定是投资IMC-MIBI生态系统还是选择环状免疫荧光方案。IMC的分辨率相对较粗,通常不足以检测细胞核和膜以外的任何亚细胞结构。MIBI提供更高的分辨率,但处理速度更慢。环状免疫荧光成本较低,提供更高的通量,辨率要高得多,具有较低的SNR。空间转录组学领域的考虑要复杂得多。基于成像的方法可以提供非常高的分辨率,但这也使它们变慢。杂交方法具有更好的灵敏度,但往往会产生较弱的荧光信号,还需要针对不同的组织重新优化,在相对较薄的切片(10至20μm)上表现蕞佳。而原位测序方法可以对更厚的样品(高达100μm左右)进行成像,但表现出蕞低的灵敏度。分辨率和通量也是某些基于条形码的方法需要考虑的关键参数。在大多数情况下,这些方法无法将空间条形码与特定细胞相关联。目前使用蕞广泛的技术ST,其分辨率较低,使得详细分析空间邻域变得更加困难。此外,灵敏度相对较低,并且每个样品的成本通常高于其他方法。然而,条形码方法在通量方面具有相当大的优势。当只需要对几个空间位置进行深度剖析时,应考虑激光捕获解剖或空间标记方法。这些方法通常更容易实现,并且可通过各种批量分析方法直接纯化选定材料进行分析。数据采集通常被认为是空间组学方法中最困难的步骤,但数据操作、分析和可视化同样重要。图像配准是一个难题,巨大数据量使空间分析变得更加复杂。大多数转录组学方法需要解码步骤,这些处理难以标准化和优化。最近,SpaceTx联盟做出了巨大的努力,发布了一组成功适用于大多数方法的Python模块——Starfish。图像分割是生物成像和计算机视觉的核心问题,并且在过去几年中受益于人工智能(AI)和深度学习的快速发展。定义细胞质膜边界是一项更复杂的任务,即使使用AI模型也无法产生有效的分割。空间条形码方法绕过了大多数图像分析要求,但条形码读数映射到的“位置”不一定对应于特定的单个细胞。为分解数据设计的工具可以提供良好的结果,如Seurat、ScateR、Scanpy和Monocle软件包,但数据生成的细微差别可能会导致偏差。专用软件包通常将原始数据的直接可视化与逐个特征矩阵的分析相结合,还提供商业选项,例如,GiottoVitesSce、Histocat、Cytomapper、SquidPy等。尽管目前的工具能对空间数据进行分析,但无法有效利用空间剖析方法最重要的特征:空间。可以通过配体-受体分析来补充,这是一种在分解的scRNA-seq中引入的细胞-细胞功能相互作用的测量方法。一种应用是在生理和病理条件下识别组织内的新细胞类型和状态。这是人类细胞图谱项目公开的目标,该项目现在正转向空间组学技术。这些方法可以揭示传统细胞类型定义未解释的基因或蛋白质表达的残余异质性,并将其与空间位置相关联。另一个问题是不同细胞类型的共定位,是否影响表达谱或与组织功能或疾病结果相关。这是最近几个大型项目的重点,例如研究肿瘤如何进化以及对治疗的反应。同时分析许多基因和蛋白质的能力也有助于发现特定空间生态位的新标记。使用空间组学方法来表征细胞类型的一个挑战是在每个位置测量的特征数量有限。克服这一限制的一种策略是,将空间测量与分解的单细胞方法相结合。重复是该领域大部分的核心问题。当研究具有刻板组织的样本时,获取多个重复并平均结果相对简单,但这对于具有高度异质且不一致的空间结构的病理组织来说是一个挑战。更复杂的是,随着数据分辨率的提高,即使在具有看似可重复结构的组织中,样品之间的异质性也暴露出来。我们仍处于空间组学时代的黎明。随着时间的推移,空间分析方法将变得更快、更可靠、更强大。这可能会与更广泛的商业仪器和试剂同时提供。剖析深度可能会继续增加,现有技术将进一步扩展到更广泛的测量范围,基因组和表观基因组测量也越来越多地在空间上进行,空间多组学技术将兴起,模仿分解的单细胞技术的演变。最后,该领域将更接近真正的3D轮廓。空间组学已经为多个领域提供了实质性和多样化的见解,包括动物发育和大脑结构以及与患者结果相关的肿瘤微环境(TME)特征。我们正处于空间组学革命的开端,但进展正在以惊人的速度发生,也将为阐明许多生物学问题做出重大贡献。